发布日期:2025-05-07 11:18 点击次数:144
天然药物的化学组成往往十分复杂, 其中含有丰富的活性成分, 其分离分析一直受到人们的广泛关注[1]。植物药在天然药物中占比突出, 植物制品在日常生活中也有较多的使用, 其有效性和安全性问题越来越为人们所关注。对于药用植物所含化学成分的准确表征有助于天然药物的标准化和现代化。然而, 由于天然药物成分复杂, 且易受外部环境的影响, 在不同的生长阶段、不同的组织部位, 其活性成分的种类和含量都可能有所不同。而开发一种直接、原位、实时的分析方法能够获取天然药物最真实的存在信息, 更有利于天然药物的成分分析、质量评价和质量控制[2]。
传统的分析方法如高效液相色谱, 虽能对样品进行准确的定性、定量分析, 但对于活性成分在天然药物具体药用部位的含量分布并不直观[3]。质谱(MS) 分析法能够提供待测化合物的分子量和结构信息, 具有样品用量少、灵敏度和分辨率高、分析速度快以及检测范围宽等优点而成为天然药物分析的重要手段之一[4]。然而传统的质谱电离过程需要在真空条件下进行, 对环境的要求较高[5]。样品在进入质谱前, 往往需要与色谱分离方法如液相色谱、气相色谱等联用, 样品的前处理较为复杂。由于对样品进行直接和原位分析存在较多困难, 难以得到待测化合物的空间信息, 其应用范围在一定程度上受到了限制。
随着对天然药物药效物质基础和作用机制研究的逐渐深入, 对其分析技术和方法学的重大创新显得尤为关键, 一种更加快速、高效和便捷的新型原位分析手段将受到更多的关注[2]。基质辅助激光解析电离质谱(matrix assisted laser desorption/ionization-mass spectrometry, MALDI-MS) 是最常用的原位质谱分析手段之一, 具有灵敏度高、分析速度快、信息直观等优点, 其在天然产物方面的应用也有系统的总结[6]。但MALDI-MS在分析样品时需要复杂的样品前处理, 而且需要将样品引入真空体系, 小分子基质对低分子量的化合物存在明显的离子抑制效应, 这些因素限制了MALDI-MS技术的进一步发展。Takats等[7]于2004年发明的解吸电喷雾电离(desorption electrospray ionization-mass spectrometry, DESI-MS) 技术, 为实现常压质谱快速分析打开了一个新的窗口, 自此敞开式原位电离质谱技术的分析方法得到了迅速发展。与传统的电离方式相比, 在DESI-MS分析过程中分析物的离子化不需要真空条件, 降低了对仪器的要求。样品只需简单的前处理, 分析时无需色谱分析过程, 操作更加方便。此外, 结合三维移动平台, 该技术能直接对待测物表面的物质分布进行分析, 可以方便地获得待测分析物的空间信息。与液滴萃取表面分析质谱法类似, 可以用带电液滴对样品不同空间位置的活性成分进行萃取、分析[8]。并且DESI离子源具有软电离特性, 离子化效率高、碎片离子少、有助于谱图解析, 该电离技术还可以与不同类型的质谱仪联用, 拓展其应用空间。
由于DESI-MS技术的诸多优点, 该技术逐渐被广泛应用于生物医学、药物分析、法医鉴定、环境监测、食品安全、材料表征等领域[9-15]。DESI-MS作为一种新兴的质谱分析技术, 针对于天然药物活性成分的分析应用, 具有样品前处理简单、响应快速、结果直观等优点。本文综述了DESI-MS技术在包括中草药和植物样品等天然药物中的分析应用进展, 并展望了该技术在中医药领域未来的应用前景。
1 DESI-MS的原理、特点、影响因素及技术进展 1.1 原理及特点图 1为DESI-MS离子源部分的实验装置示意图, 由离子源和三维移动平台等部件组成。DESI-MS的离子化是通过雾化的带电液滴撞击样品表面, 使分析物直接解吸和电离, 然后溅射进入气相, 经氮气吹扫带电液滴去溶剂化最终形成气相离子的过程[16, 17]。关于DESI-MS电离过程的物理和化学机制还没有完全理解, 目前大家普遍认同DESI技术是电喷雾电离(electrospray ionization, ESI) 和解吸附作用的综合体现, 其基本原理是液滴携带机制。
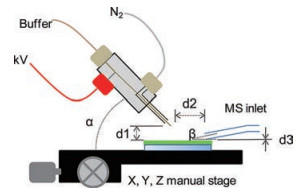 Figure 1 Schematic diagram of DESI (figure from reference[17]). kV: Spray voltage; N2: Atomization gas; d1: Distance from tip to sample; d2: Distance from tip to mass spectrometry entrance; d3: Distance from mass spectrometry entrance to surface; α: Spray incident angle; β: Collection angle; DESI: Desorption electrospray ionization; MS: Mass spectrometry
Figure 1 Schematic diagram of DESI (figure from reference[17]). kV: Spray voltage; N2: Atomization gas; d1: Distance from tip to sample; d2: Distance from tip to mass spectrometry entrance; d3: Distance from mass spectrometry entrance to surface; α: Spray incident angle; β: Collection angle; DESI: Desorption electrospray ionization; MS: Mass spectrometry
DESI-MS最基本的特征就是在开放的大气环境中对样品进行解吸电离, 其除了具有传统质谱样品用量少、灵敏度高、分析速度快、检测范围宽的优点外, 还具有原位、实时、简便、无损、高通量、绿色的特点[4]。与其他解吸离子化技术相比, DESI具有仪器设备要求低、溶剂消耗少、耐盐能力强的特点, 而且敞开式离子源更易于其他技术联用进行多层次分析[18]。DESI还可以将质谱的高通量、高灵敏度与植物的时空化学信息相结合, 可视化药用植物中代谢物的产生和位置分布。与此同时, DESI-MS取样范围小、成像分辨率低、分析特异性差、电离效率低、信号相对不稳定的缺点需要进一步改进[19]。
1.2 影响因素在解吸电喷雾电离过程中, 喷雾溶剂、样品性质、前处理方式、仪器参数及环境变化都会影响待测成分的提取和分析, 进而影响电离的稳定性和效率[19]。
对于DESI-MS来说, 带电液滴和分析物之间的微萃取和电荷转移效率很大程度上取决于溶剂的组成, 而且喷雾溶剂形成的背景噪音会干扰小分子化合物的信号相应[20]。目前常使用在喷雾溶剂中加入内标物的方法来减少基质效应、提高分析准确度[21]。
DESI-MS在生物组织切片和疾病诊断方面有着广泛应用, 此前已经有人探讨过生物组织前处理对DESI成像的影响[22]。对植物样品来说通常有三种制备方法, 简单黏贴到样品台、冷冻切片及植物印迹成像[23]。表面光滑规则的样品可直接分析; 非平坦表面(如动物组织器官、植物根茎类) 可冷冻切片制备。对于表面柔软、不规则、吸收性强的分析物, 直接成像会造成离子信号低, 因此常通过代谢物的“印迹”进行分析。然而代谢物在印迹板上会迅速消融, 导致信号强度的损失, 而且不完整的印迹会导致实验中空间分辨率的降低。为了更好地保留天然药物中的代谢物用于质谱成像, 科学家们开发了不少新的成像材料, 如功能化多孔硅、功能化玻璃、溶胶-凝胶基材料等[24-26]。
在DESI-MS分析之前还需要优化参数以便样品中的代谢物能够最佳的解吸、电离[27, 28]。最关键的参数有电喷雾溶剂的组成和流速、DESI系统的各种距离及入射角和收集角、喷雾电压等等, 它们会影响喷雾液滴的大小和速度进而影响离子化速度, 最终影响成像分辨率[29-31]。除此之外, 环境的温度、湿度也会影响分析结果, 如Newsome等[32, 33]发现湿度会影响电离的稳定性和效率, 在敞开的大气环境中, 相对湿度的微小变化会导致离子碎裂过程中灾难性的反应变化。
1.3 技术进展DESI-MS技术在天然产物分析方面有着广阔应用前景, 常用于研究药用植物中天然药物的合成、储存和生物学相关性等复杂的生命科学问题[15]。但DESI成像的分辨率受喷雾空间分辨率的限制, 一般约为200 μm, 该分辨率相较于其他质谱成像技术分辨率较低, 如MALDI-MSI空间分辨率可达1.4 μm[34, 35]。近年来, 人们做了很多努力来进一步提高DESI-MSI的空间分辨率, 如利用同步DESI-MSI降低分析物在样品表面的“洗涤效应”, 减少分析物在样品表面的分布和扩散[36]; 开发纳升解吸电喷雾电离技术(nano-DESI)[37]; 优化采样方法[38]等。为了增加质谱分析的特异性和灵敏度, Wu等[39]开发了“反应性DESI-MS”。Zhou等[40]在利用反应性DESI-MS分析大蒜时发现, 反应性DESI-MS在成分分析的同时还有助于解释大蒜素的生物活性。为了克服样品成分复杂、DESI电离效率低、仪器参数复杂、不同结构的化合物会出现离子抑制或增强效应影响信号响应准确性的缺点, DESI-MS出现了各种联用技术[41]。如Myung等[42]研制了对大分子结构和构象分析具有优势的解吸电喷雾电离-离子迁移质谱(desorption electrospray ionization-ion mobility spectrometry-mass spectrometry, DESI-IMS-MS) 技术; Dixon等[43]利用商用抽气机(air ejector, AE) 将DESI离子源与线性离子阱(linear ion trap quadrupole, LTQ) 质谱检测器连接起来, 制成了可以远距离测量样品的DESI-AE-LTQ装备; 以及带热解器探针的DESI-MS、与传统固相萃取(solid phase extraction, SPE) 相结合的SPE-DESI-MS、与大气压固相探针分析(atmospheric solids probe analysis, ASAP) 相结合的ASAP-DESI-MS、解吸电喷雾/亚稳诱导电离(desorption electrospray/metastable-induced ionization, DEMI) 等[44-47]。为了克服DESI取样范围小的局限,tp官方正版下载 Cotte-Rodriguez等[48]设计了一个非靠近式DESI离子源, tp官方下载安卓最新版本 其具有三个独立DESI喷雾头, 可以实现高进样量、高选择性、高信噪比的检测。Ma等[49]设计了包含16根平行毛细管的多通道DESI-LTQ-MS, 可以直接测试液体样品, 同时具有高通量和简单易行的特点。为了避免溶剂所形成的背景噪音, 同时能更好的对样品进行深层次分析, DESI技术衍生出了声波喷雾解吸离子化(desorption sonic spray ionization, DeSSI) 技术[50]。
2 DESI-MS在天然药物分析中的应用DESI-MS样品前处理简单、分析灵敏度高, 其已成为中药成分分析、代谢组学分析、药物质量控制的重要技术手段。DESI-MS在动物样本中的应用已经非常成熟, 如Huang等[51]采用敞开式空气辅助解吸电喷雾电离质谱(air flow-assisted desorption electrospray ionization, AFADESI) 分析了小鼠整体切片及大鼠肝组织中内源性代谢物的空间分布特征, 其正负离子化同时扫描的方式既节省了采集时间又能够检出更多种类的代谢物; Lendor等[52]使用固相微萃取(solid phase microextraction, SPME) 与解吸电喷雾电离相结合的方法分析了大脑中局部药物释放的空间模式和由此产生的生理反应程度的适用性之间的关系。DESI-MS在动物组织及生物代谢物方面的详细应用可见综述[53-59]。由于植物细胞壁的存在, 使得植物组织样本在DESI-MS的原位分析中具有一定困难性, 但经过适当的处理, 仍可用于天然药物的分析[22]。DESI-MS在天然药物产物中的分析应用主要可以分为以下四个方面, 具体实例见表 1[17, 60-77], 因DESI-MS在天然药物成像中应用广泛, 因此将采用DESI-MSI进行研究的天然药物总结成表 2[78-94]。
通过对活性成分的检测和差异比较可以发现生产过程代谢物的变化, 能够辨别植物品种差异以及发现有毒代谢物的产生, 对于药材的真伪鉴别、质量控制起着至关重要的作用。DESI-MS可对天然药物中的活性成分进行定性或定量分析, 进一步控制样品质量。天然药物往往组成复杂, 传统质谱分析需要复杂的前处理, DESI-MS可以使分析物表面活性成分迅速解吸电离、样品预处理简单、灵敏度高、选择性好, 能够用于分析中草药和其他植物样品中的活性成分, 且能够系统直观的展示活性成分在这些天然药物中的分布情况。
2.1.1 活性成分的定性分析及表征其空间分布DESI-MS在研发初期, 应用主要集中在检测生物碱类活性成分。生物碱的鉴定通常采用标准的分离和分析方法, 如高效液相色谱质谱联用法、气相色谱质谱联用法等, 这些方法灵敏度较差、样品前处理烦琐, 色谱条件要求高, 对于生物碱的分析结果并不理想[95]。Talaty等[60]将DESI-MS运用到了毒参、曼陀罗、颠茄等富含生物碱成分的植物样本的测定, 曼陀罗中19种已知的生物碱和15种颠茄中主要的生物碱都被检测到, 鉴定结果经电喷雾电离串联质谱证实是稳定可靠的。多数生物碱具有易电离的性质, DESI-MS非常适用于分析奥蔻梯木[63]、四叶萝芙木[82]、刺核藤[87]、红果樫木[90, 91]、九节木[92]、长春花[93]等富含生物碱的植物样本。在DESI-MS检测过程中要根据被测物的性质选择合适的前处理方法, 如毒参可直接分析, 而吴茱萸内含有难挥发的生物碱, 需要研磨后压片分析, 这样才能确保DESI-MS能够检测到药物的整体质量水平[61]。中药的化学组成复杂, 含有生物碱、黄酮类、有机酸类等多种活性成分, 因此, 具有检测较多种类的活性成分的能力是DESI-MS技术获得长远发展的必要条件。随着技术发展, DESI-MS也越来越多地应用于分析中草药中不易电离的活性成分, 如Klejdus等[64]使用了DESI-MS和离子阱检测器对肉桂中酚类成分作定性定量分析, 与HPLC-MS相比DESI-MS虽然没有检测到肉桂中存在的微量芥子酸, 但省去了复杂的样品前处理, 而且对于肉桂中常见的酚类成分的定性定量分析是可靠的。Jackson等[65]使用DESI在甜叶菊叶子样品中观察到一系列二萜苷类, 并分别对未处理和己烷处理的干叶进行了分析, 证明DESI-MS可以成功用于分析未处理的甜叶菊干叶片, 提供了一个直接应用DESI筛选植物材料的例子, 与使用高效液相色谱法分析所不同的是由于DESI-MS无法区分同分异构体, 在对二萜苷类定量分析时只能做到半定量。此外DESI-MS还用于检测人参皂苷[78, 96]、黄酮类[70, 83, 89]、金丝桃苷类[94]等活性成分。需要注意的是DESI主要用于分析小分子易电离的化合物, 如小分子的有机酸和生物碱, 在分析大分子化合物时具有电离不完全、结果重现性差等问题, DESI针对大分子化合物主要用于定性分析, 在目前的技术水平下并不适合做定量分析。
DESI-MS在定性分析天然药物活性成分的同时还能表征活性成分及其他植物代谢物的时空分布。如Srimany等[62]分析了抗肿瘤药物喜树碱及其衍生物在青脆枝不同部位的含量。此外, DESI也可用于分析植物生长发育过程中色素和植物激素在植物的时空分布。Müller等[66]就用DESI-MS快速识别和空间分辨及定量相对复杂的衰老植物组织中的叶绿素降解产物。还可通过DESI-MS检测植物中化合物的类型、含量去区分化合物的表型, 如Joyce等[17]通过检测洋葱的硫挥发物去区分洋葱的表型。
2.1.2 复杂样品中活性成分的定量分析天然药物在应用中多以复方配伍为主, 作为中医药宝库的精华, 经典名方因其疗效确切、应用广泛而具有很大的研究开发价值。在经典名方的研究过程中质量评价指标的定量分析不可或缺, 其药味组成复杂、化学成分众多, 分析过程中要考虑整体性、科学性, 给定量分析带来了困难。在对经典名方等复方制剂的质量控制中, DESI-MS具有极其显著的优势, 可以在无对照品情况下进行复杂样品的定性和相对含量分析, 可以对经典名方的物质基准、对应实物及配方颗粒进行质量控制。如Sun等[71]分析了不同产地15批次半夏泻心汤物质基准及对应实物, 分析结果与超高效液相色谱-二极管阵列检测(UHPLC-DAD) 的结果基本一致, 且定性分析能力远强于UHPLC-DAD, 对相对含量能进行直观的呈现。但DESI-MS在半定量时无法区分同分异构体, 所以选择半定量指标成分时要考虑对映体的影响。Qu等[72]用和孙博同样的方法分析了15批芍药甘草汤的物质基准和对应实物。值得注意的是在经典名方的研究过程中, 选择定性滤纸作为样品支持物对药液中化学成分的均匀分布造成不好的影响, 后续对于点样板的改进是十分必要的。DESI-MS不仅能对中药汤剂中的活性成分做定性定量分析, 对于其他液体型样品的分析也有优势, 如Mamun等[73]就对传统工艺制作和工业生产的抗衰老功能饮料做了分析, 分析结果反映了工艺水平对成品质量的影响。
2.2 DESI-MS分析天然药物病理变化及污染物DESI不仅能对植物生理代谢产生的活性成分进行定性、定量分析, 还可检测植物病理代谢过程中的活性成分变化, 如Tata等[74]首次利用DESI-MS对植物化学防御植物病原入侵进行定性研究, 通过检测霉菌感染的马铃薯的糖生物碱的含量波动, 探究了植物对于病原菌入侵的代谢反应, 证明仅需少量样品即可利用DESI-MS印迹成像研究简单病理系统中植物代谢变化。DESI-MS测定完整组织中的分析物时大多采用相对定量的方法, 也可以通过加入内标的方法实现待测物的绝对定量, 如Hemalatha等[76]用DESI-MSI记录了三种不同罗勒叶的叶片印记, 并记录了镰孢菌污染期间的分子表现, 显示了罗勒属物种间化学成分差异及病原物污染后分子离子峰的变化, 表明DESI可以用于大规模植物病害的快速筛查。
除此之外, DESI-MS还能够检测植物中的农药及重金属残留, 全面控制样品质量, 减轻农残对人体的危害。de Abreu等[75]采用DESI-MS技术去检测蕨类植物叶片中的不同化学态的砷化合物, 能够避免样本制备过程中的不同化合态的砷相互转化, 并用液相色谱-电感耦合等离子体-质谱(LC-ICP-MS) 联用技术对结果进行了验证。DESI-MS同时还能检测出植物样本中的农药残留, Gerbig等[77]通过检测两种杀虫剂在平枝栒子叶中的分布, 发现不同极性和溶解度的成分在叶片上的分布是不均匀的, 存在于土壤中的杀虫剂也会在数十天之后在植物样本中检测到。与此同时, 检测过程中的基质效应、样品均匀性问题及定量分析的精确性需要密切关注。
2.3 DESI-MS与薄层色谱(TLC) 联用分析天然药物活性成分对于组成成分简单、杂质干扰少的样本可以直接进行DESI-MS分析, 省略样品前处理过程, 但由于天然药物中成分过于复杂, 不经分离就进行DESI-MS分析会使不同成分之间的质谱数据互相干扰, 影响分析结果的准确性。高效薄层色谱(HPTLC) 和DESI-MS联用能够减少质谱分析过程中其他非待测化合物离子峰的干扰, 是分离、检测天然药物活性成分的有效方法。Van Berkel等[67]最早应用TLC和DESI-MS联用的方法去分析中药, 分析了白毛茛中的生物碱。Bagatela等[70]通过比较HPTLC-DESI-MS和ESI-MS两种技术对枳壳的分析结果, 发现HPTLC-DESI-MS与ESI相比能快速获得具有诊断离子的特征质谱, 能够对活性化合物快速鉴定和表征。对于天然药物中存在的色素、激素类同样能够通过TLC和DESI-MS联用的方法进行分析, 如Claude等[97]通过HPTLC-DESI-MS快速分离和鉴定了植物中的蜕皮激素(图 2)。图 2将薄层板分离出的化合物质谱图像和薄层显色图结合起来, 可直观看出不同化合物的极性大小、相对含量的多少, 若在薄层板上点上对照品, 结合质荷比, 还可以确定化合物的种类。Laub等[68]以智利蘑菇为样本, 采用高效薄层色谱-解吸电喷雾电离-高分辨率质谱(HPTLC-DESI-HRMS) 分析手段, 提供了一种快速初筛蒽醌类化合物的分析方法, 可用于食品、药品领域中蒽醌类化合物的分析。Kennedy等[69]在分析鼠尾草中具有致幻作用的克罗烷型二萜类时发现采用外部校准曲线和TLC-DESI-MSn对成分进行半定量分析具有可行性。
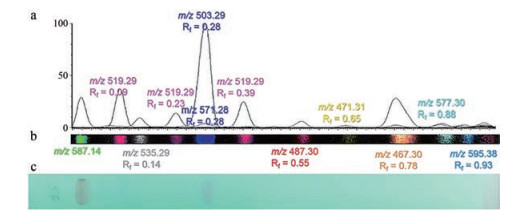 Figure 2 DESI-MSI of different molecules of plant ecdysteroids after separation on thin layer chromatography (TLC) plate (figure from reference[97])
2.4 天然药物的DESI-MSI
Figure 2 DESI-MSI of different molecules of plant ecdysteroids after separation on thin layer chromatography (TLC) plate (figure from reference[97])
2.4 天然药物的DESI-MSI DESI于2006年就开始进行成像应用, 通过成像软件进行质谱数据分析可以映射待测分子在天然药物的空间分布, 样品前处理简单、分析灵敏度高、结果清晰直观, 已经广泛用于分析不同活性成分在样本生长发育过程中的分布及含量变化。根据天然药物的性质, 在前处理过程中需要采用不同的制样方法, 有些无需前处理, 对于表面光滑平坦、质地宽厚的根、根茎类样品可冷冻切片后直接质谱成像。对于含水量高、表面柔软、不规则含有蜡状角质层的中草药多采用分子印迹间接成像的方法[98]。
2.4.1 直接质谱成像DESI-MS在天然药物直接成像的领域应用尚未普及, 直接成像大多数应用于藻类等结构简单、无明显组织分化的植物。直接DESI-MSI无需复杂的样品处理, 可保留天然药物表面微生态系统, 是了解环境因素对天然药物影响途径以及天然药物表面物理化学防御机制的有效方法。Lane等[99, 100]通过DESI将天然药物化学和生态学方法相结合, 揭示了热带海藻表面介导的抗真菌化学防御机制。不久后, Nyadong等[79]介绍了一种优化的检测海藻表面天然药物抗菌机制的DESI方案。Parrot等[80]通过对褐藻进行非目标空间代谢组学DESI-MSI, 第一次同时分析了褐藻微型表面生态系统的微生物组和代谢组, 确定了褐藻表面和横断面中代谢产物的空间分布[101]。
非藻类天然药物的直接DESI-MS成像主要集中在易于制样且活性成分含量高样品中, 如Zhang[96]对人参根部进行横切, 发现人参皂苷空间分布不均匀。Yang等[78]运用超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS) 和DESI-MSI结合正交偏最小二乘判别分析对不同年龄和部位的人参进行了鉴别(图 3)。图中颜色从浅到深表示含量从高到低, 通过检测15和18个部位和年龄标记, 发现了不同类型人参皂苷在不同部位、不同生长年限的人参中的分布规律, 对于筛选不同年龄、不同部位的人参标记物提供了一种有效的方法, 可提高天然药物及其相关生物合成途径的检测水平。
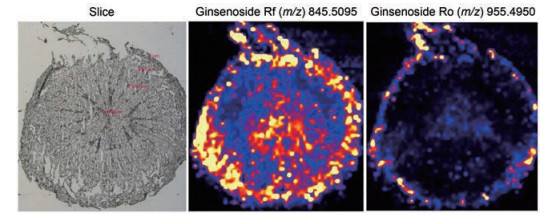 Figure 3 Spatial distribution of different ginsenosides in ginseng (the figure is selected from a part of reference[78])
2.4.2 间接质谱成像
Figure 3 Spatial distribution of different ginsenosides in ginseng (the figure is selected from a part of reference[78])
2.4.2 间接质谱成像 对于有明显组织分化、器官发育完全的植物来说最常采用分子印迹间接成像的方法[16]。虽然含有角质层的材料也能进行直接质谱分析, 但喷雾溶剂穿透角质层需要较长时间, 而且不能确保所分析化合物能够被完全解吸和吸附, 还对样品的前处理以及仪器的参数设置具有较高要求。而间接成像降低了因角质层存在而造成的基质效应, 增加了目标化合物的溶解、解吸, 同时保留了化合物的空间信息。目前多孔聚四氟乙烯和硅胶薄层色谱板等吸附剂材料是常用的样品印迹分析材料, 表现出较高的信号稳定性和可重复性[102]。虽然聚四氟乙烯作为印记材料具有灵敏度高、信号稳定等诸多优点, 但是价格较昂贵, 而且在DESI-MSI的过程中并不需要特定类型的表面印记材料。Ifa等[103]就将豆蔻和小鼠的脑组织的横切面印压在打印纸和TLC板等普通表面上进行DESI-MSI分析。在印记成像的过程中, 印迹的效率受到样品和印迹材料表面的化学性质以及转移到表面的化合物的性质的影响, 所以通过溶剂萃取及加热等辅助手段, 可以改善印迹效率, 提高离子信号强度和稳定性。如Cabral等[84]运用DESI-MSI通过加热或溶剂萃取辅助等不同的印压条件分析了马铃薯、银杏叶及草莓在不同印压条件的薄层板上重要化合物的分布, 在改进的印压条件下能够获得更大的转移效率、得到更稳定的离子信号, 使对样品的间接成像分析更为精确。
间接DESI-MSI可以在同一张印迹板上绘制天然药物各种代谢物的谱图, 能够确定代谢物的时空分布和特定产量, 而且间接DESI-MSI是了解天然药物内各种成分化学变化、成分库-源关系以及代谢物时空分布的有效方法。间接DESI-MSI应用广泛, 可通过间接DESI-MSI分析活性成分在天然药物中的时空分布; 检测天然药物代谢物及其相关生物合成途径; 对物种进行分类学鉴定。
2.4.2.1 间接DESI-MSI分析活性成分在天然药物中的时空分布Freitas等[83, 89]采用间接DESI-MSI研究了薄荷叶片中一些关键黄酮类化合物的空间分布。由此可见间接DESI-MSI对于分析活性成分在中草药不同部位分布特征具有重要意义, 通过了解活性成分的时空分布, 可以更好的控制药品质量, 保证用药的安全性和有效性。Li等[81]在分析贯叶连翘的叶片和花瓣的过程中, 提到了有关植物材料直接成像的关于样品和仪器参数选择的一些考虑。在此之前, Li等[85]通过对大麦叶直接和间接DESI成像进行比较, 发现对于含有角质层的植物样本间接DESI能够表征更丰富、更准确的物质信息。后来Li等[88]用同样的方法对百脉根做了代谢物的质谱成像, 发现对于不稳定的羟氰苷类也可以做到精确成像。聚四氟乙烯是其中最常用的印迹材料, 能够保留植物中的代谢物而且具有优异的重现性和定量能力, 如Li等[81]就通过聚四氟乙烯间接成像的方法分析了贯叶连翘叶片和花瓣中金丝桃苷类化合物的分布。Thunig等[86]采用聚四氟乙烯为印迹材料, 对曼陀罗的叶子进行了间接DESI-MSI, 揭示了托品烷生物碱、东莨菪碱、己糖等在曼陀罗叶子中的空间分布, 并用质谱联用技术去证实结果的可靠性。Kumara等[82]使用DESI-MSI检测了四叶萝芙木根、茎、叶、果实中不同吲哚类生物碱的空间分布, 并用超高效液相电喷雾电离质谱对各种生物碱进行了半定量分析, 实验结果证明吲哚类生物碱在萝芙木四种组织中分成不同的簇存在(图 4)。间接DESI-MSI的研究为药用植物不同部位活性成分分布提供了一个空间框架, 为以后结合组学方法研究生物组织特异性奠定了基础。
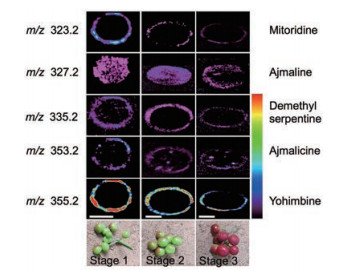 Figure 4 Mass spectrometric images of indole alkaloids distributed on TLC imprint of Rauvolfia tetragona fruit slices with different growth cycles (figure from reference[82])
2.4.2.2 间接DESI-MSI对物种进行分类学鉴定
Figure 4 Mass spectrometric images of indole alkaloids distributed on TLC imprint of Rauvolfia tetragona fruit slices with different growth cycles (figure from reference[82])
2.4.2.2 间接DESI-MSI对物种进行分类学鉴定 间接解吸质谱成像还能够定位不同植物组织中的次级代谢产物, 进而根据这些种间代谢产物的差异对物种进行划分。在对金丝桃属植物的间接DESI-MSI时就发现不同的金丝桃属植物其金丝桃素和间苯三酚的空间分布有所不同[94]。Kato等[92]利用间接解吸质谱成像分析了吲哚生物碱在两个属的物种中的空间分布。Hemalatha等[93]以长春花为例说明DESI对于植物细微特征的成像在识别品种差异、生长代谢方面有着重要作用。
2.4.2.3 间接DESI-MSI分析天然药物代谢物及其相关生物合成途径同一种成分在同一植物的不同组织也有不同的空间分布, 传统的分析方法忽略了代谢物的空间分布模式, 而运用DESI-MSI可以直观看到某一活性成分的组织分布, 对于研究活性成分的合成和转运的可能途径具有重要意义。Kumara等[90]对红果樫木种子生长发育过程中的罗希吐碱及其相关化合物的时空分布进行了质谱成像, 发现在植物的生长发育过程中, 成分的分布和含量变化暗含着某种规律。Kumara等[91]后来又对树木幼苗中的其他代谢物做了质谱成像。Suma等[87]探讨了刺核藤果实和种子中喜树碱的时空变化规律。Freitas等[83, 89]通过DESI对不同成熟程度的薄荷叶片中的典型碳水化合物、游离氨基酸等做了质谱成像, 表明了植物生长发育过程中代谢物的库-源关系。后来还采用DESI-MSI研究了薄荷叶片中一些关键黄酮类化合物的空间分布, 并将关键黄酮类的空间分布图像与植物中这些代谢物的主要生物合成途径相关联, 其研究结果可以揭示特定代谢产物在植物组织中的合成途径和时空分布(图 5), 对于增加给定代谢物的提取率极为重要。
 Figure 5 DESI imaging of key metabolites in luteolin synthesis pathway in mint leaves (figure from reference[83])
3 总结与展望
Figure 5 DESI imaging of key metabolites in luteolin synthesis pathway in mint leaves (figure from reference[83])
3 总结与展望 DESI-MS已经广泛应用于中草药、植物样本等天然药物中活性成分的检测, 作为一种新兴的技术, 其在中药的质量控制、成分的定性定量分析、探究植物生长发育不同阶段的成分变化规律、代谢物的库-源关系分析、物种的分类学鉴定、植物次生代谢合成途径的研究方面具有很大潜力。作为天然药物质谱分析技术手段, 其前处理简单、分析速度快、检测范围宽, 能够对活性成分的含量和时空分布进行直观呈现。在分析过程中通过比较含量和成分的差异可以达到物种鉴别、质量控制的目的。DESI-MS还能够将这种物质的空间分布和植物的生长发育过程连接起来, 有效的加强了生物分子之间作用、转化的路径研究。但在DESI-MS的分析过程中仍然存在着空间分辨率低、分析特异性差、信号响应易受外界干扰的问题, 因此样品制备、参数优化仍然至关重要。针对这些问题, DESI-MS在技术上也在不断完善, 如nano-DESI的出现就显著地将DESI-MSI的分辨率从200 μm提升至12 μm。一般来说, DESI-MS对于易电离的生物碱类能够获得很好的分析结果, 对于一些难电离的物质还存在定量分析不准确, 结果重现性差等问题。对于数据的处理也需要更多数据库的建立及软件工具的开发。相信随着技术的进步这些问题都能够被很好的解决, DESI-MS能够在中药的标准化、现代化和其他植物制剂的检测中发挥更大的作用。
作者贡献: 刘龙婵负责综述初稿的撰写; 李依璠负责查找背景资料; 张方丽负责综述格式的修订; 李林楠负责综述的框架设计和修改; 王峥涛负责完善综述的框架; 杨莉负责综述的修改。
利益冲突: 所有作者均声明不存在利益冲突。