发布日期:2025-05-07 08:05 点击次数:140
纳米医药在肿瘤等疾病的检测、预防和治疗中具有巨大潜力。与传统药物相比,纳米药物可以提高疏水药物水溶性、延长药物的体内半衰期、抗肿瘤药物靶向递送和可控释放以及克服细胞耐药等[1-2]。纳米药物也可以达到多模态诊疗的目的,其通过携带多种药物表面修饰的特异性分子(如抗体)靶向肿瘤细胞或肿瘤微环境达到联合治疗,同时其携带的显像剂可对肿瘤组织进行显像,实现多功能一体化诊疗[3]。目前研究较多的纳米体系有脂质体、纳米沉淀、纳米高分子载体、纳米无机-有机杂化等[4]。然而在过去的20年中,这些纳米载体在体内、外实验中都面临着巨大的挑战,粒径大、结构不稳定以及表面理化性质复杂等均在一定程度上增加了其负面效果,限制了其进一步的临床转化[5]。
目前在纳米载药体系设计方面,包括粒径调控、粒径分布、结构可变、表面功能性修饰等,都或多或少存在着理论框架的空白,如何设计结构稳定、功能良好的纳米载体尚缺乏科学的标度关系[6]。人体内环境中血液流速快、黏度大,又含有大量不同的生物蛋白,同时体内pH环境、氧化还原环境等都在不断的变化,且体内保护性的免疫清除系统会高效地清除外来异物[1, 7-10]。因此简单设计的纳米载体若没有足够的理论支持,就会导致纳米药物的理化性质存在许多不确定性,在进入体内血液循环后极易产生不稳定崩解,与带电生物分子发生不良反应,或者被网状内皮系统(reticulo-endothelial system,RES)快速清除。这种理化性质缺陷造成的纳米药物体内效果差、临床转化困难成为目前纳米药物发展的一大瓶颈问题。
对于如何使纳米药物在体内正确位置正常发挥功效,目前普遍的策略是进行表面修饰或结构改造[11-13]。如通过表面修饰含N或O的亲水性聚合物[聚乙二醇(polyethylene glycol, PEG)、聚N-(2-羟丙基)甲基丙烯酰胺等]减少蛋白吸附,提高体内稳定性;通过修饰柔韧的亲水聚合链(如PEG等)避免RES的快速清除,延长体内循环时间[14-15];而对于增强疾病部位的药物分布或富集,主要是通过环境响应性材料的修饰或者靶向分子的修饰。由于肿瘤微环境具有血管增生异常、pH较正常组织低、温度较高、氧化还原环境不同等特点,同时肿瘤细胞表面具有肿瘤特异性抗原(tumor specific antigen,TSA)或肿瘤相关抗原(tumor-associated antigen,TAA),且肿瘤微环境中也含有一些特异性蛋白分子,这些都可作为治疗靶点,通过对纳米载体进行环境响应性设计或者靶向修饰可实现靶向递送和控制释放[16-17]。特异性强的抗体可靶向结合相关蛋白[18-20],实现纳米药物的靶向富集,而环境响应性材料,如温度敏感型材料聚(N-异丙基丙烯酰胺)[poly (N-isopropyl acrylamide, PNIPAM)][21-22]、pH敏感的聚(β-氨基酯)[poly(β-amino ester)][23]以及对还原敏感的二硫键[24]等可根据肿瘤微环境变化实现药物靶向释放,从而实现组织或细胞水平的药物精确递送,提高治疗效果。在亚细胞或细胞器水平,不同细胞器内pH也不相同,如内涵体内pH为5~6,而溶酶体内的pH为4~5,因此pH敏感性纳米载体药物也可实现细胞内的精确释放[25-26]。然而这对解决纳米药物体内稳定、靶向分布以及功能发挥远远不够,仍需要大量的理论研究证实。通过物理化学原理以及相应的标度关系精确设计纳米载体,保证载体结构的牢固以及功能的最优化,才是纳米药物的基础,也是实现临床转化的根基[6]。
本文在我们前期研究基础上,分析纳米体系粒径、表面电荷、弗洛里赫金斯参数(Flory-Huggins interaction parameter,χp-s)等理化性质,结合纳米医药发展中遇到的体内、外瓶颈问题,率先建立了系列纳米医药体系的物理药剂学参数与解决其体内、外瓶颈问题之间的定量、定性关系式。我们初步定义了纳米物理药剂学,即利用物理化学的相关理论修正传统物理药剂学原理中的相关参数,阐述、证明并解释纳米医药新剂型的热力学和动力学性质。并通过实例进一步验证该体系在纳米载体运用中的重要性,确定物理药剂学原理在纳米载体构建及应用中的重大意义。
1 纳米物理药剂学相关基本原理的建立如上所述,纳米制剂的性能参数是在体外静态环境下获得,而实际应用中遇到的人体内环境(如血液)成分复杂,纳米药物与生物分子之间存在多种相互作用等,这使得纳米药物的精确合理设计面临巨大挑战。而肿瘤微环境特殊的病理条件对纳米药物的靶向性和稳定性有更加严格的要求。纳米载体的构建存在着热力学和动力学两大方面的影响因素,体内环境的热力学和动力学条件也决定了纳米药物在体内能否表现出良好的功能[27]。我们前期研究对不同载体在选择性溶液中的热力学影响因素进行了大量探索分析,建立了纳米载体相关模型及其对应的标度关系,并通过透射电镜进行了验证(图 1)[16]。
https://www.trustwalletk.com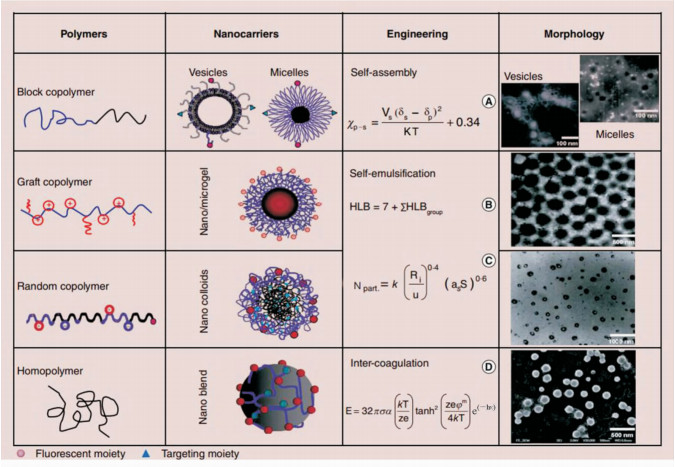 图 1
纳米载体相关模型及其对应的标度关系
Fig 1
Related models of nanocarriers and their corresponding scaling relationship
The picture[16] application has been licensed for this review. Equation A: The Flory-Huggins interaction parameter (χp-s), where δp and δs are the solubility parameter of the polymer and solvent, respectively, Vs is the molar volume of solvent, K is Boltzmann constant, T is temperature and the value of 0.34 is entropic contribution; equation B: The HLB, where HLBgroup is the constant of different groups along polymer chain; equation C: The particle number calculation in emulsion (Npart), where k is a consistent in the range of 0.37 to 0.53, and Ri, u, as and S are the rate of total radicals produced, the rate of the particle volume increase, the surface area of a surfactant and total number of the surfactant, respectively; equation D: The electrostatic repulsion energy (E), where σ, α, k, T, z, e, φm, κ and h are the electronic constant of the solvent, the dielectric constant of the solvent, the Boltzmann constant, temperature, the number of ions, the capacity of solvent, the double layer potential of the diffusion layer, the thickness of the double layer and the distance between two particles, respectively. ⊕: Positive charge;
图 1
纳米载体相关模型及其对应的标度关系
Fig 1
Related models of nanocarriers and their corresponding scaling relationship
The picture[16] application has been licensed for this review. Equation A: The Flory-Huggins interaction parameter (χp-s), where δp and δs are the solubility parameter of the polymer and solvent, respectively, Vs is the molar volume of solvent, K is Boltzmann constant, T is temperature and the value of 0.34 is entropic contribution; equation B: The HLB, where HLBgroup is the constant of different groups along polymer chain; equation C: The particle number calculation in emulsion (Npart), where k is a consistent in the range of 0.37 to 0.53, and Ri, u, as and S are the rate of total radicals produced, the rate of the particle volume increase, the surface area of a surfactant and total number of the surfactant, respectively; equation D: The electrostatic repulsion energy (E), where σ, α, k, T, z, e, φm, κ and h are the electronic constant of the solvent, the dielectric constant of the solvent, the Boltzmann constant, temperature, the number of ions, the capacity of solvent, the double layer potential of the diffusion layer, the thickness of the double layer and the distance between two particles, respectively. ⊕: Positive charge; 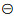 : Negative charge; HLB: Hydrophilic to lipophilic balance
: Negative charge; HLB: Hydrophilic to lipophilic balance
嵌段共聚物胶束有明确的“核-壳”结构,即疏水内核、亲水外壳,同时其粒径分布较窄,tp官方正版下载约10~100 nm, tp官方下载安卓最新版本可在体内保持较好的稳定性,应用较为广泛[28]。制备过程中,胶束的粒径和粒径分布受到其在自组装过程中相关反应的影响。例如,两亲性的嵌段高分子自组装胶束时,两个高分子在溶剂中的溶解性差异是其主要的自组装驱动力[29]。而对于这种溶液中大分子的自组装,其行为可以用χp-s[30-31]来描述,见图 1方程A:
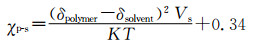
其中δpolymer和δsolvent描述的是两个高分子片段在溶剂中的溶解度参数,Vs为所用溶媒的摩尔体积,K是玻尔兹曼常数,T是温度,0.34是体系熵的贡献。因此可根据χp-s通过调节两端共聚物的长度以及选择不同溶解度的单体组装合适的胶束载体。如在水溶液中,根据极性相近原则,两嵌段共聚物的亲水端(PEG)水溶性好(χp-s<0.5),可以较好地在水溶液中链状展开,而疏水端由于不易溶于水(χp-s>0.5),易卷曲缠绕,同时各个单体的疏水端都由于不易溶于水而相互吸附缠绕卷曲,形成毛线球样的胶束内核,使亲水端暴露在外形成了胶束的亲水外壳。如此我们可通过控制亲水端或者疏水端的长度,从而控制外壳的厚度及内核的体积。将水溶液换成其他溶剂也是如此。而对于嫁接型(一条链上多处分支)或随机组合型的共聚物(不同的聚合物单体形成一段接一段的长链),其组装过程主要受表面电位的影响,而这个参数可以通过单体比例、溶剂性质以及介质的pH值调控(图 1B、1C)。这种形式的载体设计组装可依据纳米粒子数目(Npart)[16]相关关系调节,见图 1方程C:
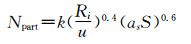
其中k是常数(0.37~0.53),Ri是自由基的总产率,u是纳米粒子的体积增长率,as是表面活性剂占比,S是表面活性剂分子数目。该共聚物的两亲性可通过亲水疏水平衡关系( 图 1方程B)确定。这个亲水疏水平衡(HLB)值同样受到pH值和单体成分[M]的影响,而[M]又可以决定as和S,进而决定Npart。例如纳米微凝胶,大量的胶体纳米粒子在一定条件(如pH、不同溶剂)下可由于表面存在的活性分子互相连接形成大的凝胶,其空隙中充满了分散的介质,而该凝胶的大小必然与交联的胶体纳米粒子数量相关,同时该交联反应也会受到表面电荷及表面活性剂分子数目的限制,从而影响凝胶的大小、表面电位等理化性质。对于均相聚合物形成的纳米混合体系,其形态结构主要受静电排斥力(E)[32]的影响,见图 1方程D:
图 1方程B)确定。这个亲水疏水平衡(HLB)值同样受到pH值和单体成分[M]的影响,而[M]又可以决定as和S,进而决定Npart。例如纳米微凝胶,大量的胶体纳米粒子在一定条件(如pH、不同溶剂)下可由于表面存在的活性分子互相连接形成大的凝胶,其空隙中充满了分散的介质,而该凝胶的大小必然与交联的胶体纳米粒子数量相关,同时该交联反应也会受到表面电荷及表面活性剂分子数目的限制,从而影响凝胶的大小、表面电位等理化性质。对于均相聚合物形成的纳米混合体系,其形态结构主要受静电排斥力(E)[32]的影响,见图 1方程D:
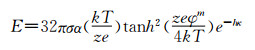
其中σ是溶剂的静电常数,α是溶媒的介电常数,k是玻尔兹曼常数,T是温度,z是电子数目, e是溶剂的溶解度,φm指扩散层中的双层电位,κ指层厚,h指两个粒子间距。例如将聚乙烯醇(polyvinyl alcohol,PVA)和聚乳酸(polylactic acid,PLA)在水溶液中共混时,PLA不溶于水,载体的静电排斥力主要来自亲水聚合物聚乙烯醇,这种静电排斥力可以调节载体双层膜的厚度,静电排斥力越大双层膜的厚度越小。因此在载体合成过程中可通过控制聚乙烯醇的含量调节其稳定性和形态,从而设计我们所需要的载体。
热力学方程能够帮助我们更加科学地判断和鉴定载体的合成,而动力学方面的研究可以帮助我们更清楚地认识载体的理化性质与功能的相关关系。大量研究证明纳米载体的理化性质随纳米载体形式的不同而多样化,决定了其功能及运用(图 2)。纳米药物的体内稳定性与载体表面电荷密度(ρcharge)、表面链密度(ρchain)、HLB值和载体在溶剂中的溶解度(A2)等相关[16, 33];载药量、载药效率可通过载体粒径(D)、核体积(Vcore)或表面链数目(Nchain)等控制,而药物释放效果则与粒径(D)、表面链数目(Nchain)、表面链密度(ρchain)及载体溶解度(A2)有关[34]。纳米药物的靶向富集可通过控制粒径大小和表面修饰抗体等分子,利用EPR效应实现。粒径大小、表面电荷密度也影响着纳米药物的胞吞效果[16, 35]。我们前期结合体内环境条件,通过热力学和动力学相关理论建立了纳米药物的物理药剂学相关原理[16],这将为研究纳米药物理化性质与生物相互作用之间的相关关系提供科学参考,也将为纳米药物在生物体内的广泛运用提供有力的理论支持。
 图 2
纳米载体的理化性质及其与生物应用的相关关系
Fig 2
Physical and chemical properties of nanocarriers and their correlations with biological application
The picture[16] application has been licensed for this review. Ploymer A: Block coplymer; ploymer B:Graft coplymer; ploymer C: Homopolymer.
图 2
纳米载体的理化性质及其与生物应用的相关关系
Fig 2
Physical and chemical properties of nanocarriers and their correlations with biological application
The picture[16] application has been licensed for this review. Ploymer A: Block coplymer; ploymer B:Graft coplymer; ploymer C: Homopolymer. 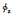 : Surface potential; ρchain: Surface chain density; ρcharge: Surface charge density; A2: Second virial coefficient; CMC: Critical micellization concentration; D: Diameter; EPR: Enhanced permeability and retention; HLB: Hydrophilic lipophilic balance; Nagg: Number of agglomeration; Nchain: Chain number; t1/2: Half-life in circulation; T: Temperature; Vcore: Volume of core
2 基于纳米物理药剂学原理的纳米医药精细裁剪
: Surface potential; ρchain: Surface chain density; ρcharge: Surface charge density; A2: Second virial coefficient; CMC: Critical micellization concentration; D: Diameter; EPR: Enhanced permeability and retention; HLB: Hydrophilic lipophilic balance; Nagg: Number of agglomeration; Nchain: Chain number; t1/2: Half-life in circulation; T: Temperature; Vcore: Volume of core
2 基于纳米物理药剂学原理的纳米医药精细裁剪
此部分将以胶束为例介绍如何通过调控纳米药物构建过程中的重要参数实现胶束组装的最优化,从而在生物体内发挥良好作用。前文提及的对于一个两嵌段的共聚物胶束,其自组装的源动力受χp-s影响,其中Hildebrand-Scatchard溶解度参数(δ)又是关键因子[31]:
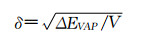
其中δ是物质在溶剂中的溶解度,ΔΕVAP是溶剂的蒸发能,V是所用溶剂的摩尔体积。正如前文所述,在大分子的溶液中,一个含有两种不同溶解度的高分子(如嵌段聚合物)形成纳米粒子时需要外部溶剂的推动力,其一个自组装热力学条件是其中一段高分子的溶解度较高,即亲水端χp-s<0.5;另一个条件是其溶解度低的一段(疏水段)的χp-s>0.5。因此,两亲性聚合物在溶液中自组装时必须满足上述热力学条件。如需获得球形胶束,还需调整载体材料的组成,因为不同材料组成将导致最终形态不同。描述这一动力学参数的是体系在溶液中的堆积参数β:
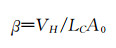
其中VH是聚合物中疏水片段在溶剂中所占据的空间体积,LC是该疏水片段的长度,A0指亲水片段在溶剂中末端所占的面积。两亲性嵌段共聚物自组装的形态会随β值变化而变化,正常情况下,在复合热力学自组装条件下,0<β<1/3时两亲性嵌段共聚物将自组装成球形胶束;而当1/3<β<1/2时,则会形成中空的囊泡结构;当其数值进一步提高(1/2<β<1) 时,将会形成棒状结构;当β接近1时,最终会分层形成平面双层结构。所以,在满足热力学条件的基础上,还要满足动力学条件0<β<1/3,才能保证“核-壳”结构球形胶束的形成[36]。在满足热力学和动力学条件下,我们可以根据生物体内微环境特点,通过改变嵌段共聚物段链的长度调整胶束的微观结构和理化性质。目前有较多理论可用于描述胶束的形成过程,如deGennes定标理论和自洽平均场理论[6]。
达到自组装条件后通过调节亲水链(Nhydrophobic)和疏水链长度(Nhydrophilic)来改变胶束的粒径(D),其相关关系为[37]:D∝Nhydrophobic0.16 Nhydrophilic0.6,胶束的粒径大小一般为10~100 nm,其粒径大小可通过动/静态光散射仪表征,获得体系在溶剂中的粒径和绝对总质量。通过计算和理论模拟,我们可以进一步获得胶束的微结构,如核和壳的维度等(核/壳比,Dcore/Dcorona)。该参数及结构的理化参数直接关系到胶束的实际应用,如较长、较密集分布的表面亲水链可以提高体内稳定性。因此,在设计结构稳定、体内长循环的载体胶束时,控制疏水/亲水链长的比例、优化胶束的微观结构是可靠的方法[38]。载药能力是评估胶束在体内、外应用的一个重要指标[39]。正常情况下,载药能力和载药效率取决于体系聚合物的组成分子与药物分子在溶剂中的相互作用,即疏水作用,药物分子和载体内核材料之间的亲和力也可以用校正后的弗洛里赫金斯方程描述。同时,载体的载药能力还受到疏水内核链段的疏水性、静电作用、溶剂极化作用、氢键等因素的影响。最重要的影响因素是药物分子与疏水高分子之间的疏水作用。解释、描述这些影响载药能力的因素的线性关系如下[40]: vVx,其中SP是药物在异质相中的分配系数,R2是伦敦色散力来源的溶液超额摩尔散射,π2是药物的非极性/极性能力,∑α2是氢键酸性度,∑β2是氢键碱性度,Vx是麦高文特征体积,c、r、s、a、b和v是回归系数。此外,在尽可能增加药物装载量的同时,不应忽略载体体系(纳米制剂)的稳定性,因为随着药物装载纳米制剂的水溶性变差、稳定性降低,如果过载纳米制剂将会出现聚沉甚至沉淀,此处最应该考虑的问题是如何优化载体组成结构使装载量和稳定性之间达到平衡。
vVx,其中SP是药物在异质相中的分配系数,R2是伦敦色散力来源的溶液超额摩尔散射,π2是药物的非极性/极性能力,∑α2是氢键酸性度,∑β2是氢键碱性度,Vx是麦高文特征体积,c、r、s、a、b和v是回归系数。此外,在尽可能增加药物装载量的同时,不应忽略载体体系(纳米制剂)的稳定性,因为随着药物装载纳米制剂的水溶性变差、稳定性降低,如果过载纳米制剂将会出现聚沉甚至沉淀,此处最应该考虑的问题是如何优化载体组成结构使装载量和稳定性之间达到平衡。
纳米制剂的稳定性对其临床应用和剂型的评价至关重要。纳米制剂的稳定性受到浓度、组成聚合物的相对分子质量、药物的装载量、药物的性质、血液组成、血流速度等的影响。一位体质量50 kg的成年人体内约有4 500 mL的血液高流速动,且黏度高,这对需经静脉给药的纳米制剂的稳定性带来挑战,也会导致药物遗漏。对于胶束纳米制剂而言,首先面临的是崩解的问题。如果胶束纳米制剂稀释后的浓度低于其临界胶束浓度(即聚合物形成胶束结构的最低浓度,CMC),胶束纳米制剂将会崩解,使药物遗漏等不利影响因素凸显[28]。因此,对胶束纳米制剂,必须明确低于CMC时的结构变化,这是决定其体内、外应用的重要热力学参数,具有重要的实际意义。一般情况下,CMC的大小由组成聚合物的两个嵌段的比例和长短决定。在给定的亲水链段时,其疏水链的长度越长,CMC越低。同时,疏水药物分子的包载也能一定程度地降低CMC。如常用的泊洛沙姆(Poloxamer, 商品名Pluronic)共聚物在水溶液中CMC为10-4~10-3 mol/L,但研究表明其会受到疏水/亲水链的长度比的显著影响[41]。因此,我们可以通过增加疏水链长降低CMC,从而提高胶束纳米制剂的体内稳定性。
纳米制剂的体内稳定性还受到其他因素的影响,如纳米制剂与血液中的蛋白质或生物分子的相互作用。为了降低生物大分子的吸附和包裹,目前常用的方法是在载体表面修饰含有N、O原子的亲水性高分子,如PEG、聚丙烯酰胺、聚乙烯醇等[7, 42]。此外,这些亲水性高分子链上大量的N、O原子能与水分子形成氢键,从而在纳米制剂表面形成大量的水合层,减少了纳米制剂体系与溶剂之间的界面能,提高稳定性;同时,水合层的形成能增加纳米制剂体系之间的空间排斥效应,从而降低其相互作用。以胶束为例,PEG化胶束的稳定性通常取决于胶束的相对分子质量、PEG的表面链密度(surface area per chain)和分子构象。长链相对分子质量较大的PEG比短链相对分子质量较小的PEG能更有效地防止蛋白吸附,但修饰过多的PEG可产生过强的排斥效应从而抑制胶束与细胞相互作用。我们发现,胶束药物复合体在含蛋白溶液中的稳定性主要受面链密度比的影响[28]。如图 3所示,我们建立疏水链/亲水链长度比(Nhydrophobic/Nhydrophilic)与核面链密度/表面链密度比(ρcore/ρcorona)之间的相关关系,当长度相近的疏水链和亲水链进行自组装后,其表面链密度(ρcorona)较小,易吸附生物蛋白;而当亲水链长于疏水链时,如长链相对分子质量较大的PEG(Mr=3 400),此时表面链密度(ρcorona)较大,从而使核面链密度/表面链密度比减小,使胶束的静电排斥力增加,不易吸附蛋白[6]。因此为了保证胶束的体内稳定性,需尽量降低CMC,同时在表面修饰合适表面链密度的亲水性聚合物形成保护层[33]。
 图 3
胶束中疏水链/亲水链长度比(Nhydrophobic/Nhydrophilic)与核面链密度/表面链密度比(ρcore/ρcorona)间的相关关系
Fig 3
Relationship between hydrophobic/hydrophilic block length ratio (Nhydrophobic/Nhydrophilic) and the surface area per chain inside the core and corona surface-chain density (ρcore/ρcorona) of micelles
The picture[6] application has been licensed for this review. ρcore=Score/Nagg, ρcorona= Scorona/Nagg. Scorona: Surface area of corona; Score: Surface area of core; Nagg: Number of agglomeration; NBMA: Length of butyl methacrylate (hydrophobic); NAM: Length of acrylamide (hydrophilic)
图 3
胶束中疏水链/亲水链长度比(Nhydrophobic/Nhydrophilic)与核面链密度/表面链密度比(ρcore/ρcorona)间的相关关系
Fig 3
Relationship between hydrophobic/hydrophilic block length ratio (Nhydrophobic/Nhydrophilic) and the surface area per chain inside the core and corona surface-chain density (ρcore/ρcorona) of micelles
The picture[6] application has been licensed for this review. ρcore=Score/Nagg, ρcorona= Scorona/Nagg. Scorona: Surface area of corona; Score: Surface area of core; Nagg: Number of agglomeration; NBMA: Length of butyl methacrylate (hydrophobic); NAM: Length of acrylamide (hydrophilic)
结合我们设计的稳定纳米胶束药物,通过荧光标记对药物的瘤内富集进行了示踪(图 4),可以发现高Scorona/Nagg,即高表面链密度的胶束药物荧光明显强于低表面链密度(Scorona/Nagg)的胶束药物,反映了高表面链密度的胶束药物在体内循环时更能保持结构的稳定性,且具有更长的循环时间,从而达到更好的瘤内富集。因此我们前期探索建立了纳米药物物理药剂学原理,并根据该原理设计了具有良好稳定性的胶束载体,并发现其在生物运用中具有优越的功能。
物理药剂学原理是纳米载体的设计及生物运用的基础,这一原理始终贯穿整个纳米药物的研发过程。目前对于胶束而言,其理化参数建立的标度关系已经日趋详细,而对于其他构型的纳米载体亟需大量的结构性理论基础研究。
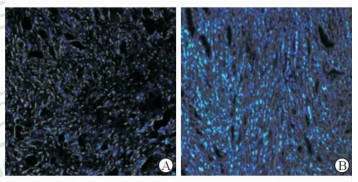 图 4
免疫荧光验证胶束的表面链密度与瘤内富集的相关性
Fig 4
Effects of corona surface-chain density (ρcorona=Scorona/Nagg) on micellar intratumor accumulation obtained by inverse fluorescent microscopy
The picture[6] application has been licensed for this review. A: The tissue slice from solid tumor transferred by micelles with low Scorona/Nagg; B: The slice obtained from the solid tumor accumulated the micelles with high Scorona/Nagg. The blue color was from nuclei as stained by 4', 6-diamidino-2-phenylindole; the green color generated from fluorescein isothiocyanate accumulated in the solid tumor. ρcorona: Corona surface-chain density; Scorona: Surface area of corona; Nagg: Number of agglomeration. Original magnification: ×40
3 小结与展望
图 4
免疫荧光验证胶束的表面链密度与瘤内富集的相关性
Fig 4
Effects of corona surface-chain density (ρcorona=Scorona/Nagg) on micellar intratumor accumulation obtained by inverse fluorescent microscopy
The picture[6] application has been licensed for this review. A: The tissue slice from solid tumor transferred by micelles with low Scorona/Nagg; B: The slice obtained from the solid tumor accumulated the micelles with high Scorona/Nagg. The blue color was from nuclei as stained by 4', 6-diamidino-2-phenylindole; the green color generated from fluorescein isothiocyanate accumulated in the solid tumor. ρcorona: Corona surface-chain density; Scorona: Surface area of corona; Nagg: Number of agglomeration. Original magnification: ×40
3 小结与展望
纳米物理药剂学原理是决定其体内外性能是否良好的关键因素,这些基本的物理学参数或化学参数直接影响载体的构建、结构的稳定性以及载体与各种分子的相互作用。通过大量研究证实的参数与载体性能的相关关系可以为纳米载药体系的生物利用提供科学参考。我们率先尝试建立的这些纳米药物的理化性质与体内相互作用的标度关系虽然对纳米医药的制备具有极大的指导意义,但是尚未完全建立,仍需要大量的理论基础和后续实验研究进行补充,从而为纳米药物在体内更有效地发挥功能提供有力支持。通过物理药剂学原理解析多种构型纳米药物理化性质标度关系,将有利于解决纳米药物发展的瓶颈问题。而在稳固的理论基础上建立的稳定纳米体系,进一步赋予纳米体系的体内精准靶向,实现其精准靶向治疗对提升肿瘤的纳米治疗效果具有举足轻重的意义,这将成为目前纳米药物的重要发展趋势。